체크밸브 제어 레이저 유도 마이크로젯 약물전달 시스템
Abstract
A microjet with a velocity of approximately 140 m/s and 150 μm diameter is injected into a narrow nozzle by a pressure wave delivered by laser-induced bubble expansion. The driving force of such an injector is a discontinuous pulse of a 10 Hz period. Every time a pulse ends, unnecessary air bubbles are introduced into the injector due to the decrease in its internal pressure. Such air bubbles interfere with the flow inside the injector, deteriorating its performance. Therefore, we developed a nozzle closure that reacts automatically to the driving force with a pulse shape. When the flow occurs, the nozzle is opened; when it does not, the nozzle is closed to prevent unnecessary air inflow. In this study, a microjet injector was applied to needle-free drug injection. We compared and analyzed the drug penetration performance of the injector with and without the nozzle closure attached to the injector.
Keywords:
Microjet, Laser-induced bubble, Ball-check valve, Needle-free, Drug-delivery1. 서 론
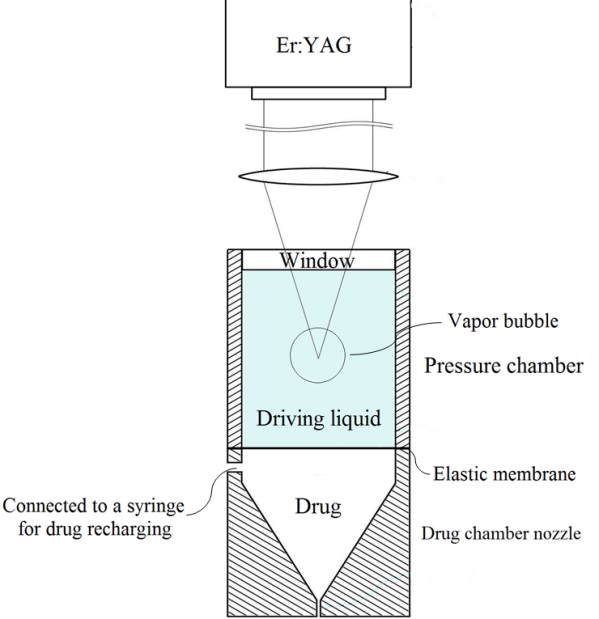
고속 마이크로 제트에 의한 약물 용액이 피부의 표피를 직접 관통하여 약물을 주입하는 마이크로 제트 약물 전달 시스템이 다양한 연구자들에 의해 연구된 바 있다[1-4]. 특히, Fig. 1에 도시 된 바와 같은 레이저-유도 버블 구동 마이크로 제트 주입 방법은 최근에 개발된 약물주입 시스템으로 알려져 있다[5-7]. 해당 약물 주입 시스템은 10 Hz에서 2,940 nm 파장의 펄스 레이저 조사를 이용하여 마이크로 제트 형태의 약물을 방출한다. 구동액으로써 물을 충전한 압력 챔버에 고강도 레이저 펄스를 집중하며 이로인하여 폭발적인 기포 성장을 일으키며 이 때 탄성 막이 약물을 노즐로부터 밀어내도록 한다. 전체 시스템은 효과적인 경피 약물 전달에 필요한 마이크로 제트의 충분히 빠른 배출 속도를 달성하도록 설계되었다[4,8].
레이저 조사에 의한 압력 챔버에서 기포의 압력 펄스 발생과는 별도로, 약물 챔버 노즐에서 발생하는 압력차에 의하여 에어 포켓이 유입되며, 특히 펄스 샷 수가 증가함에 따라 약물 분사량이 감소됨을 관찰하였다[8]. 마이크로 제트의 각각의 펄스 방출 시 노즐 출구를 통하여 외부 공기가 유입되며 이는 약물 노즐 내부에서 성장하는 에어 포켓을 형성시킨다. 멤브레인의 수축 직후의 순간적인 압력 강하는 노즐이 외부 공기를 흡입하도록 하며 유입된 에어 포켓의 크기가 커짐에 따라 마이크로 젯 속도는 피부 침투가 더 이상 불가능해질 때까지 점차 감소한다. 선행연구로써 동일한 레이저 구동력을 사용하여 기포 팽창에 의한 약물전달 메커니즘을 가지는 디바이스가 소개된 바 있으며 이는 레이저 분사 때마다 외부 시린지에서 자동적으로 약물이 충전되도록 약물시린지를 스텝모터로 가동하였으며 레이저 발진 시 신호를 스텝모터 제어회로에 전달하여 적절한 작동주기를 맞추도록 하였다. 하지만 이는 약물 분사가 반복됨에 따라서 젯의 분사량이 감소하였으며 약물 챔버내의 압력변화속도를 스텝모터의 비교적 느린 반응속도로 제어하기 어려웠을 것이라고 추측된다[8].
따라서, 본 연구는 약물 분사기 내부에 공기 포켓을 유입하지 않도록 하는 새로운 분사기 방식을 개발하여 앞서 설명한 마이크로 젯트 성능 저하의 문제를 해결하는 것을 목표로 한다. 구체적으로는 마이크로 젯 분사기의 최적 성능을 위해 노즐 배출구를 통해 공기가 스며 들지 못하게 하므로써 약물 주사의 반복에 관계없이 마이크로 제트의 주사 성능 및 피부 침투 깊이를 유지하는 데 중점을 둔다. 따라서 약물 챔버의 중간 오리피스를 개방 또는 폐쇄하기 위한 메커니즘을 갖는 볼 체크 밸브가 인젝터에 도입되었고 시험을 진행하였다.
본 논문에서는 경피 약물 전달을 위한 레이저 펄스 구동 마이크로 제트 시스템에 적합한 새로운 분사 노즐에 대한 상세한 설명을 기술하고자 하였으며 이러한 볼 체크 밸브를 사용하는 시스템은 레이저 발사 횟수에 관계없이 시스템의 고성능을 유지하였다. 이 시스템은 피부 침투 깊이 등 기존의 비침습식 의료 기기에 대한 요구 사항을 충족시키기 때문에 레이저 유도 마이크로 젯 장치의 매우 바람직한 기술로 사료된다.
2. 실험 셋 업
2.1 탄성 막으로 분리 된 압력 챔버 및 약물 노즐
Fig. 1과 같이 약물 전달 시스템은 물로 채워진 상부 압력 챔버로 구성된다. 압력 챔버 아래의 탄성 멤브레인은 시스템 챔버를 하부 약물 챔버 노즐 및 상부 압력챔버로 분리한다. 주사기를 통해 노즐에 연결된 추가 약물 저장소는 노즐 외부에서 필요한 용량의 약물을 공급한다. 이 연구에서는 물을 대체 의약품으로 사용하였다. Er:YAG 레이저를 사용하여 150 µs 펄스 지속 시간에서 2.940 µm의 레이저를 조사하였다. 고압 챔버의 물에 해당 레이저를 조사하였고 이때 물의 레이저 흡수 계수는 15,000 1 /cm이다[9]. 모든 실험에서 레이저 에너지는 1 J이고 레이저 플루언스(Laser fluence)는 530 MW/mm2로 설정하였다. 100 mm 초점 거리의 볼록 렌즈를 사용하여 레이저 빔을 압력 챔버에 집중시켰으며 마이크로 제트 인젝터 내부에서, 제트 분사를 위한 구동력은 압력 챔버 내부에서 레이저-유도된 기포의 급속한 팽창으로부터 발생한다. 이러한 기포의 팽창은 탄성 멤브레인을 밀어내게 된다. 이로 인해 생성된 마이크로 제트의 100 m/s 이상의 속도를 가지며 직경이 150 내지 300 µm인 노즐로부터 방출된다.
2.2 약물 챔버 및 볼 체크 밸브 노즐
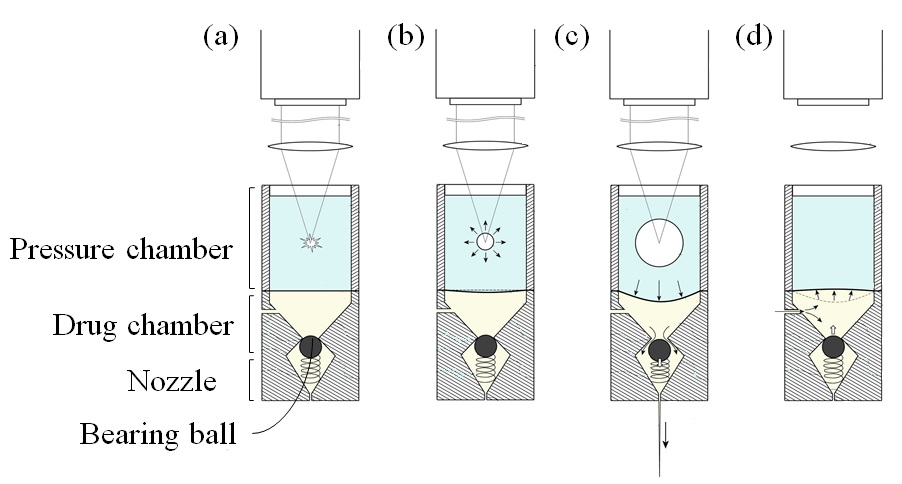
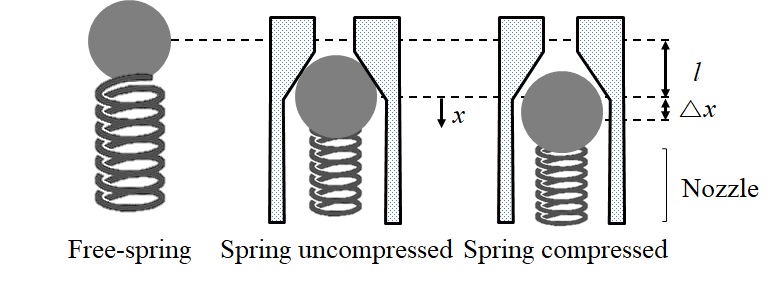
Fig. 2는 약물 챔버 노즐이 두 영역 사이의 흐름의 개방 또는 폐쇄를 제어하는 볼 체크 밸브로 설계된 계패 구조를 나타낸다. 멤브레인의 탄성 팽창으로 인해 노즐에서 마이크로 제트를 배출하는 동안 볼 체크 밸브가 열린다. 그 후, 구동 압력 챔버에서 발생하는 팽창 기포가 탄성 복원하여 압력강하가 발생하므로 이에 따라 멤브레인 탄성막이 수축되고, 볼-체크 밸브가 폐쇄된다. 체크 밸브는 스프링 장력을 통해 볼베어링이 왕복운동하여 개방 및 폐쇄할 수 있도록 한다. 베어링 볼은 오리피스의 정확한 밀봉 및 폐쇄를 위해 밸브보다 큰 직경을 갖는다.
2.3 제트 속도 및 볼 운동 측정
주사 횟수에 관계없이 시스템 성능의 일관성을 보장하기 위한 본 연구에서 설정한 기준 중 하나는 지속적인 마이크로 제트 속도이다. 제트 속도는 고속 카메라(Phantom v711)를 사용하여 측정하였다. 고속 이미지는 제트 속도를 촬영하기 위하여 112 × 600의 해상도, 49,026 fps의 촬영속도로 저장된다. 챔버 내부의 베어링볼과 미량 입자(0.25-0.50 µm)의 이동은 208 × 504의 해상도로 40,000 fps로 측정하였다. 픽셀 당 실제 측정 거리는 촬영 된 이미지의 초점 거리에서 계산되며 이로인해 속도를 계산하였다. 또한 제트 속도는 제트가 처음 노즐을 떠날 때 즉시 측정하였다.
2.4 시료 및 조직 샘플
약물 전달 유닛의 안정적인 성능에 대한 다른 기준은 발사 횟수에 관계없이 돼지 피부의 약물 침투 깊이가 일정한지 여부이다. 표적 샘플에 사용된 돼지 피부는 각질층 두께 20-30 µm에서 10-30 MPa의 항복인장 강도를 갖는다. 인간 피부의 항복인장 강도는 2-15 MPa이며, 이는 본 연구에서 사용한 돼지 조직 샘플보다 적다[10,11]. 그럼에도 불구하고, 돼지 피부는 인간 피부와 유사한 형태 및 층 구조를 갖기 때문에 침투 실험의 시료로 사용하였다. 피부층의 단면을 가시화하기 위해 조직 샘플을 10% 포름 알데히드 용액에 고정한 다음 파라핀에 첨가하였다. 이후 샘플을 슬라이스 절단하고 H&E (hematoxylin-eosin) 염료로 염색하였다. 또한 현미경을 사용하여 (Axiophot) 피부의 단면도를 관찰하였다.
3. 결과 및 논의
3.1 인젝터 성능 저하를 유발하는 노즐로의 부적절한 공기 유입
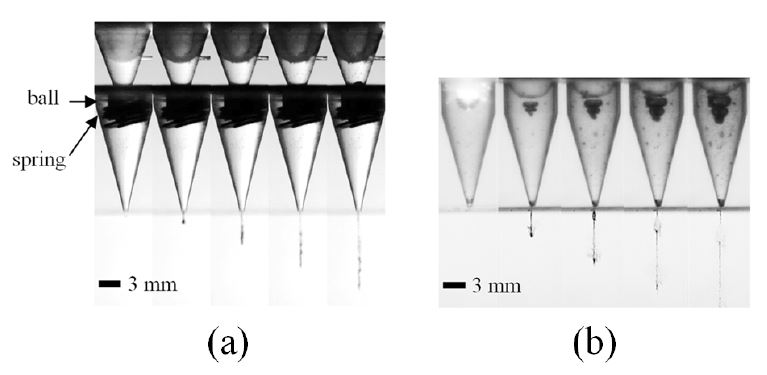
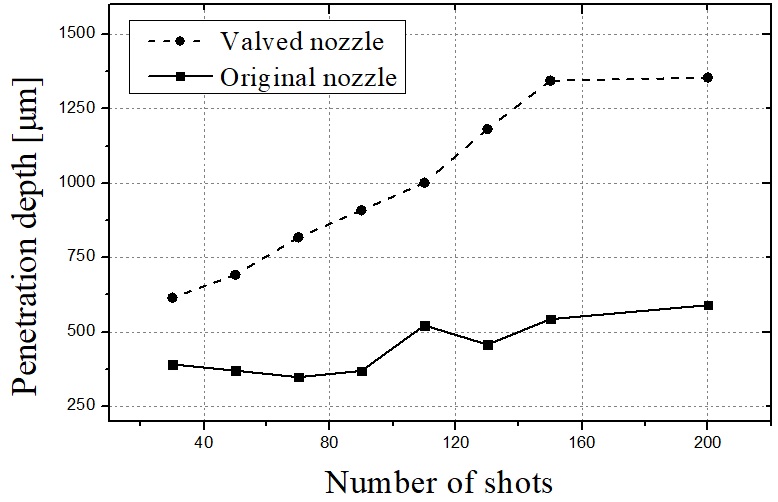
Fig. 3은 6초 간격으로 60초 또는 600샷의 지속 분사 시간 동안 촬영된 약물 챔버 노즐 내부의 이미지를 나타낸다. Fig. 3(a)는 체크 밸브가 없는 원래 노즐이며 Fig. 3(b)는 볼 체크 밸브가 적용된 노즐의 내부를 나타낸다. 샷 수가 증가함에 따라, Fig. 3(a)의 탄성 막 아래의 약물 부피가 공기에 의해 흡수되는 곳에서 에어 포켓이 크게 성장한다. 이에 비하여 볼 체크 밸브가 적용된 노즐 내부에는 마이크로 젯의 샷 수에 관계없이 에어 포켓이 형성되지 않았음을 볼 수 있다. Fig. 4는 샷 수에 대한 마이크로 제트의 속도를 나타낸다. 삼각형 기호는 원래의 노즐을 적용한 마이크로 제트 속도를 나타내고 사각형 기호는 체크 밸브를 탑재한 노즐의 속도이다. 샷 수가 증가함에 따라, Fig. 4(a)와 같이 에어 포켓이 성장하며 이에 따라 제트 속도가 현저하게 저하된다. 초기 속도는 140 m/s에 도달하지만 약 150회의 마이크로넷 분사 이후 급격히 감소하여 60 m/s에 가까워져 피부 침투에 더 이상 적합하지 않게 된다. 한편, 볼 체크 밸브가 장착된 노즐은 테스트 샷 수에 관계없이 140 m/s의 일정한 속도를 유지하였다. 이러한 지속적인 성능은 약물 노즐 내부의 에어 포켓이 제거됨에 따른 결과이며 제시된 바와 같이 마이크로제트 성능이 유지될 수 있었던 증거이다.
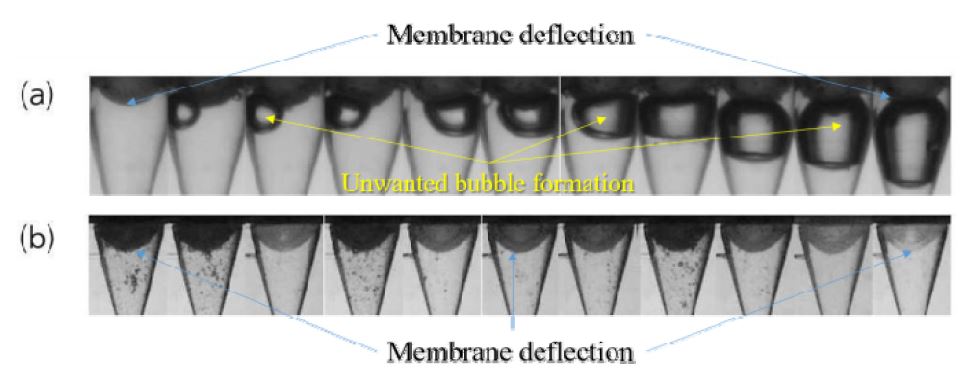
Sequential images of air pocket in the nozzle. These images were captured at 60 shots injection interval: (a) original nozzle without any valve system (b) Nozzle with a check valve (laser fluence of 530 MW/mm2).
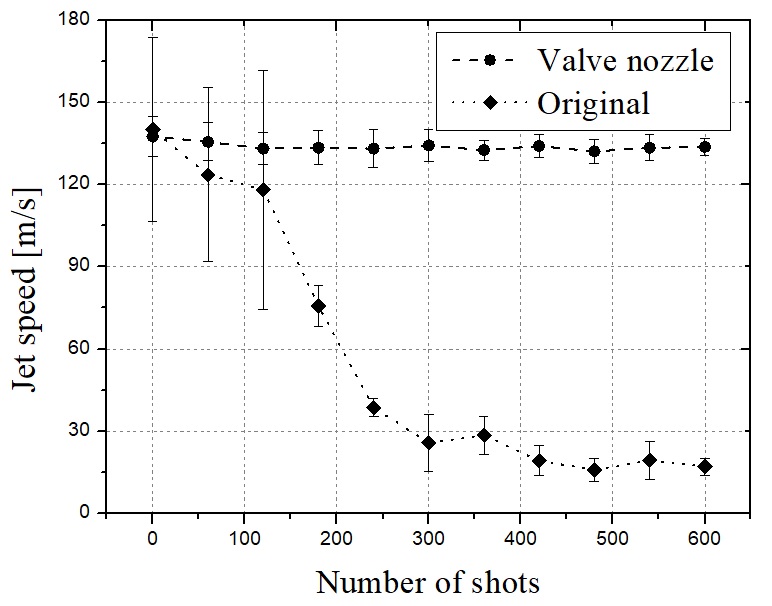
y axis: jet speed, x axis: number of shots. Jet speed measurement value was average of 10 jet speed of each cases and error bars indicate standard deviation.
Fig. 5는 20.4 µs 간격으로 촬영한 마이크로 제트 형성의 순차적 이미지를 보여준다. Fig. 5(a)는 원래의 노즐을 장착한 인젝터에서 마이크로 제트 배출 과정을 설명하고 Fig. 5(b)는 체크 밸브가 적용된 인젝터에 해당하는 이미지이다. 10 개의 측정에 기초하여 각각의 인젝터에서 143 m/s 및 140 m/s의 마이크로 제트 속도를 얻었으며 생성된 마이크로 제트 형상은 미립화 현상이 없이 직선성을 나타내어 타박상 및 잠재적인 표면 오염을 야기하는 비효율적인 침투 성능을 방지할 수 있다.
3.2 마이크로 제트 성능 최적화 분석
체크 밸브 시스템은 외부에서 공기가 유입되는 것을 방지하지만 동시에 노즐 내부의 흐름을 중단 시킬 수 있다. 따라서 상부 및 하부 약물 챔버 사이에서 체크밸브에 의해 발생하는 압력 손실을 최소화해야한다. Fig. 5(a)에 도시된 바와 같이, 레이저 조사 후 약 20.4 µs 경과 후, 볼이 목에서 아래로 이동하여 마이크로 제트가 발생하였다. 하부 약물 챔버에서 액체 약물로 전달된 에너지는 식 (1)에 의해 표현 될 수 있다. 움직이는 볼베어링의 운동 에너지를 약물로 전달한다고 가정하였으며 볼베어링이 스프링을 밀면서 변위를 주면서 에너지의 일부를 흡수하게 된다고 가정하였다. 흡수된 에너지를 스프링 포텐셜 에너지(1/2 kx2)로 나타낼 수 있다. 또한, 특정 경과 시간 동안 노즐 상부 오리피스와 볼 사이의 유동이 상부 챔버로부터 통과하는데, 이는 조사 임펄스 동안 볼이 밸브를 열고 닫는 데 걸리는 시간이다. 식 (1)의 오른쪽에 있는 세 번째 항은 유동 통로 동안 노즐 오리피스가 개방되는 한 연속 유동이 있다고 가정하여 첨가된다. 여기서, ρwater(= 1000 kg/m3)는 약물 용액의 밀도이고, An (= 3.142 mm2)는 노즐 위의 오리피스의 면적이고, vn (= 5 m/s)는 노즐 넥에서의 유속에 해당한다. 챔버 내부에서 0.25-0.50 µm 크기의 미량 입자(안료)를 추적하여 고속 카메라를 사용하여 vn= 5 m/s를 측정하였다.
| (1) |
여기에서 Eliquid는 액체 약물에서 수확 된 총 에너지이며, mball은 볼 질량(0.11 g)이며, vi는 볼의 초기 속도이며, ks는 스프링 계수이며, l은 스프링의 초기 자유장 길이이며, Δl은 스프링의 초기 변위, x는 스프링에 부착된 볼의 위치이고 Δx는 압축 스프링의 최대 변위이다(Fig. 6 참조). 또한 변위는 스프링의 원래 길이보다 훨씬 작거나 Δx ≪ l이다. 따라서 식 (1)은 다음과 같이 근사 할 수 있다.
| (2) |
하부 약물 챔버에서, 볼의 운동은 식 (3)에서와 같이 항력에 의해 저항을 받는 것으로 가정된다[12].
| (3) |
베어링볼은 수렴-발산의 형상의 벽으로 둘러싸여 있으며 스프링 바로 옆에 위치하여 유동 조건에 영향을 줍니다. 이러한 복잡한 형상으로 인해 항력 계수 CD를 계산하는데 필수적인 레이놀즈 수를 추정하기 어렵게 된다. 따라서, 본 연구에서는 방정식의 곡선을 실험 값에 피팅하여 항력계수를 추정하였다. 식 (5)는 볼의 최대 변위값을 가지는 데이터 포인트에 맞추어 피팅하였다. 계수 값 조정을 조정하여 c=1.271 kg/m라는 값을 얻었으며 v는 베어링볼의 운동 속도이다. 스프링에 의한 또 다른 저항력은 다음과 같다.
| (4) |
이후 전체 약물 챔버 내부에서 발생하는 힘의 균형은 다음과 같은 미분 방정식으로 표현할 수 있다.
| (5) |
해당 방정식에서 변수분리법을 사용하여 시간에 대해 적분하였고, t에 대한 볼 위치 x의 분석적 표현이 얻어진다.
| (6) |
| (7) |
이러한 솔루션은 스프링력의 반대 방향과 초기 볼 방향에 대한 항력이 있기 때문에 진동 동작이 포함되었음을 의미한다. 그러나, Fig. 6에 나타난 바와 같이, 노즐의 형상으로 인해 볼이 이동할 수 있는 거리에는 제한이 있다. 따라서 식 (5)에는 시간 범위(예 : 0 <t <telapse)가 있습니다. t = 0에서 공이 움직이기 시작하고 t = telapse에서 공이 초기 위치로 돌아와 상단 노즐 목에 부딪친다. 이 시간 범위 내에서 공은 진동이 발생하기 전에 노즐 상단 오리피스에 부딪히면서 공의 움직임을 멈추게 된다.
본 연구는 4 개의 상이한 스프링 계수 ks, 즉 12.68 N/m, 23.49 N/m, 40.07 N/m 및 64.18 N/m을 고려하였다. 특히, 5 mm, 7 mm, 9 mm, 11 mm 및 13 mm의 5 가지 초기 변위 l을 테스트하였다. 또한, 각각의 레이저 펄스에 대한 단일 스프링 압축동안 베어링볼 운동을 고속카메라로 촬영하였으며 이로써 얻어진 베어링 볼의 초기 속도 vi는 3 m/s로 설정되었다.
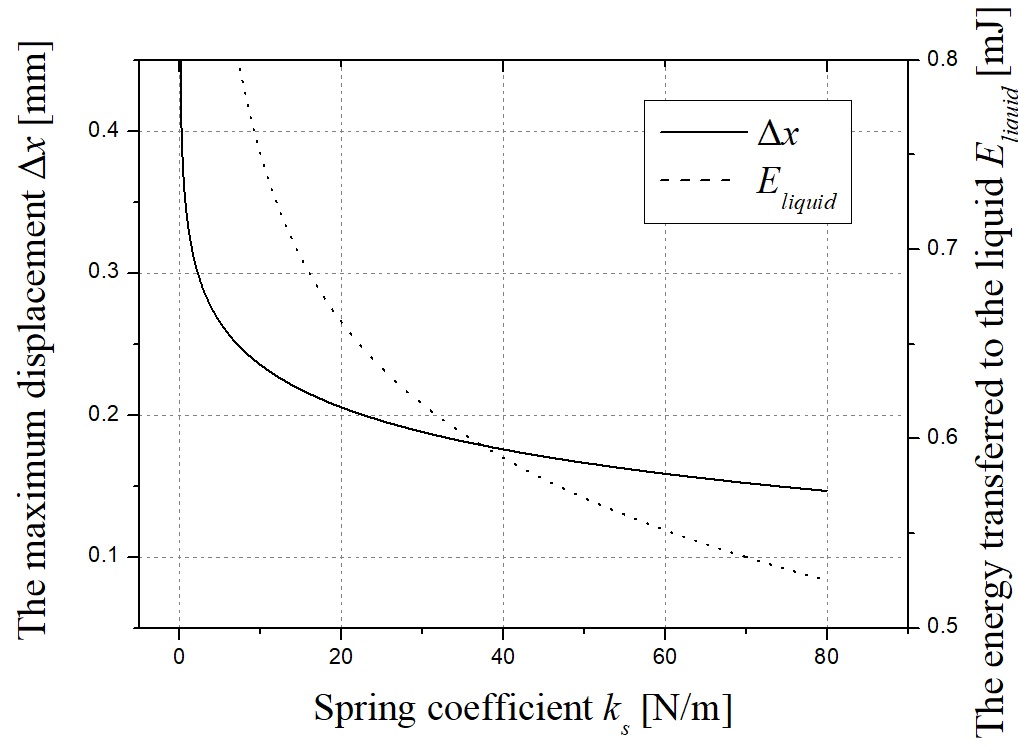
Fig. 7은 식 (6)을 풀음으로써 4가지 다른 스프링 계수에 대한 스프링의 변위를 보여줍니다. 멤브레엔 탄성막의 펄스 운동은 스프링이 x축에 표시된 시간 동안 완전히 압축되어 회복되기 이전까지 볼 체크 밸브를 개방한다. 각 곡선의 최대값은 밸브가 열려있는 동안 스프링의 최대 변위 Δx에 해당한다. Fig. 8은 스프링 Δx의 최대 변위와 5 mm의 초기 변위에서 스프링 상수 ks에 따라 액체 약물 Eliquid에 전달된 총 에너지를 의미한다. 여기서, Δx는 식 (6)의 최대값이며 ks의 함수이다. Eliquid는 식 (2)에서 계산된 값이다. 스프링 상수 ks가 증가함에 따라 Eliquid가 감소한다. 따라서, ks의 이상적인 최적값은 0이 되고, 약물로 전달된 에너지 Eliquid는 최적 성능을 위한 최대값을 갖는다. 그러나 스프링 상수 ks는 0이 아닌 최소값을 갖는다. 각 레이저 펄스는 10 Hz에서 조사되기 때문에 볼 체크 밸브의 동적 개방 폐쇄는 0.1초 이내에 끝나야한다. Fig. 9는 스프링 계수에 따른 스프링의 전진-후진 운동에 대하여 경과된 시간을 나타낸다. telapsed는 레이저 조사 임펄스 동안 볼베어링이 밸브를 열고 닫는 데 걸리는 시간이다. 식 (6)을 x가 0에 가까워지는 경우에서 풀 경우 t의 결과 값을 얻을 수 있다. 스프링 계수가 감소함에 따라 telapsed는 레이저 펄스 지속시간(150 µs)에 도달할 때까지 증가한다. 이때 telapsed가 0.1초를 초과하면 볼 체크 밸브가 닫히지 않아 결국 외부 공기가 노즐 배출구로 흘러 들어가게 된다. telapsed 시간이 0.1 s인 해당 스프링 계수는 0.002 N/m로 계산된다. 스프링 계수가 감소함에 따라 스프링 Δx의 최대 변위는 증가하며 이는 모두 위에서 언급한 0.1초 동안 유효하다. 따라서 하부 챔버에서 약물로 전달되는 에너지가 효과적으로 증가하고, 노즐 출구로부터 분사되는 마이크로 제트가 더 빠른 속도에 도달한다. Fig. 10에 도시 된 실험 결과는 바로 그 사실을 보여준다.
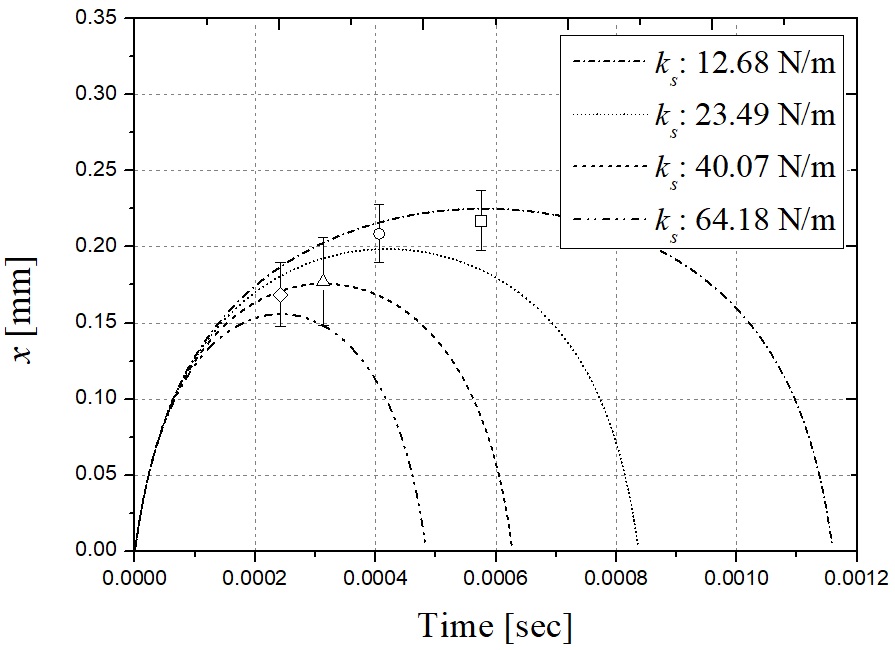
y axis: calculated spring displacement x, x axis: time using 4 different ks. l = 5 mm. The experiment value for ks = 12.68 N/m, ks = 23.49 N/m, of ks = 40.07 N/m, ks = 64.18 N/m are shown. The measurement value was average of 10 jet speed of each cases and error bars indicate standard deviation.
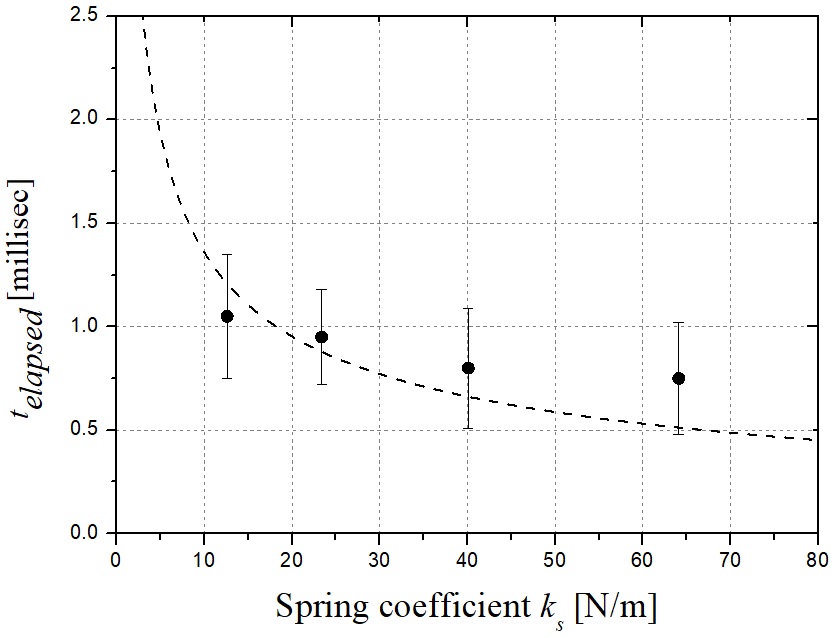
y axis: calculated telapsed, x axis: time using 4 different ks. l = 5 mm. The experiment value for ks = 12.68 N/m, ks = 23.49 N/m, of ks = 40.07 N/m, ks = 64.18 N/m are shown. The measurement value was average of 10 jet speed of each cases and error bars indicate standard deviation
y axis: microjet speed, x axis: ks when l = 5 mm. The measurement value was average of 10 jet speed of each
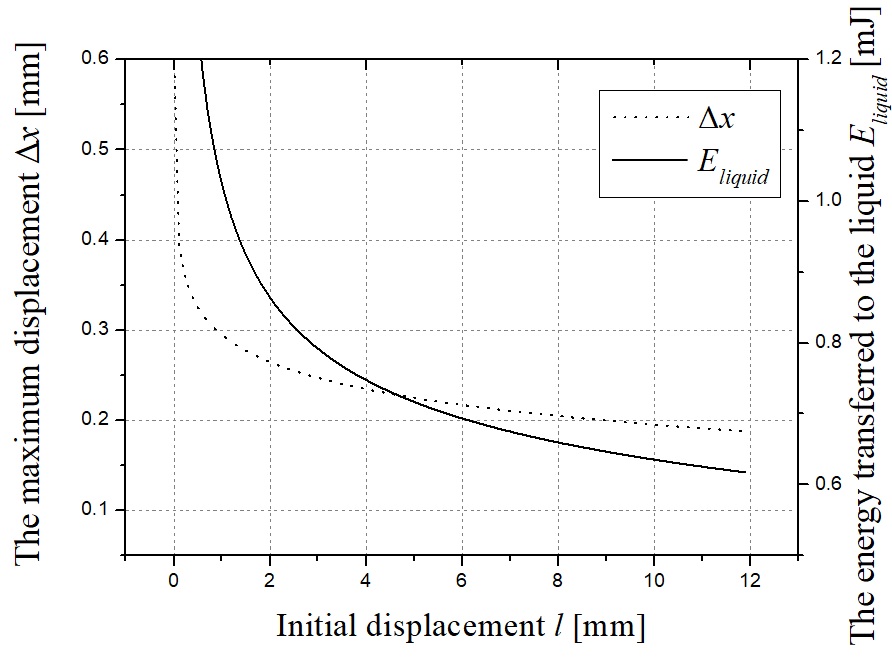
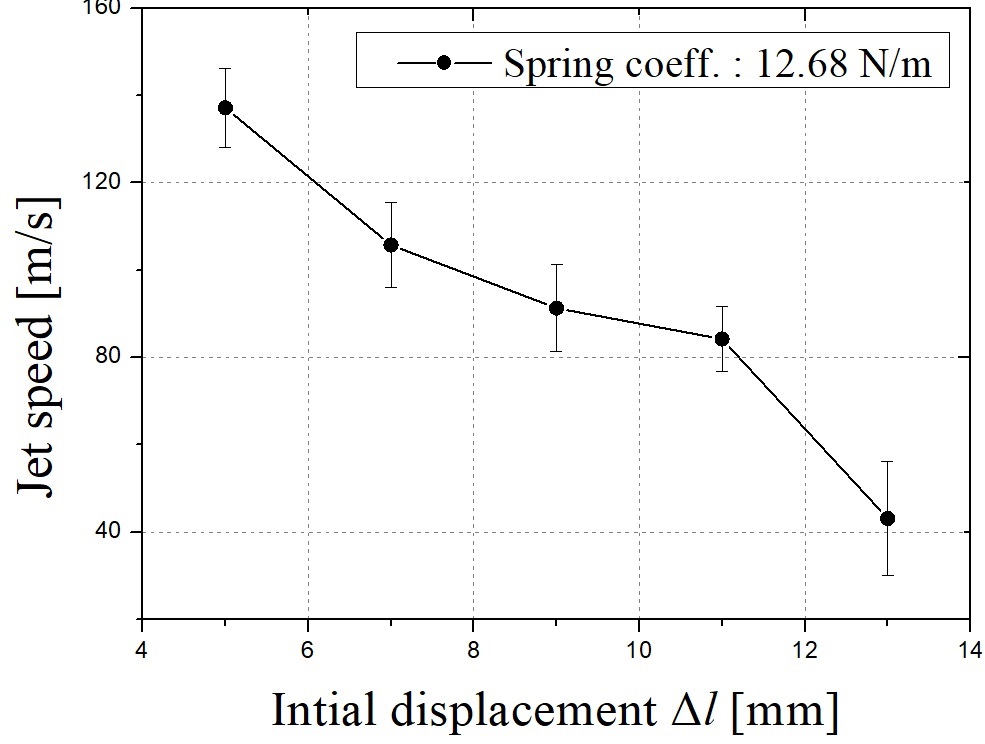
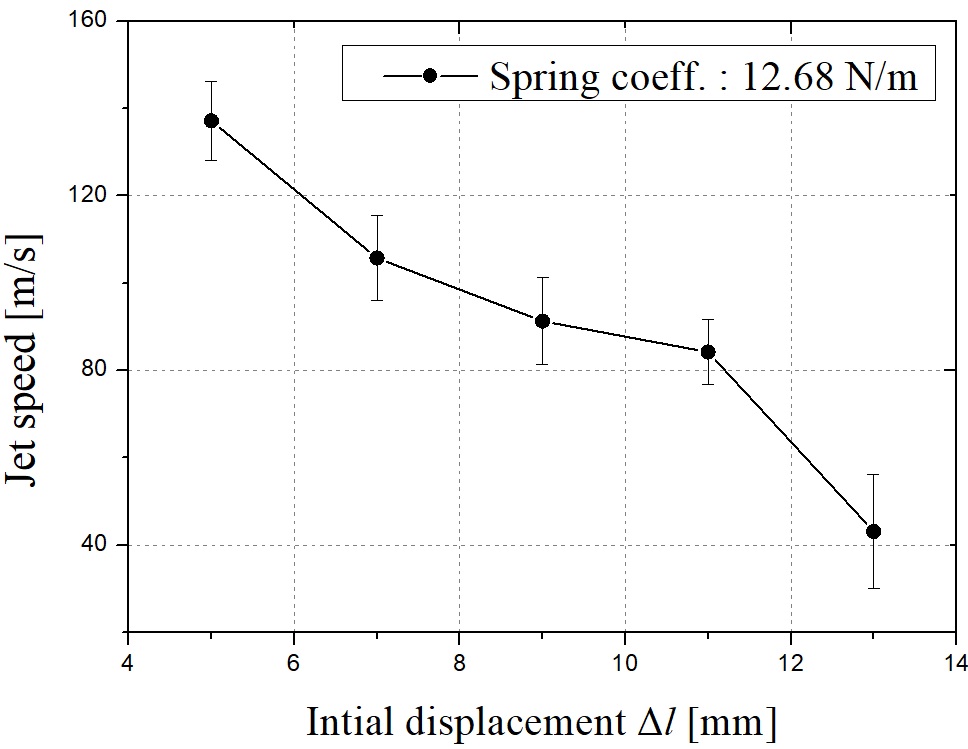
스프링 계수를 고정하고 스프링 자유장 길이를 조절하여 유사한 분석과정을 진행할 수 있다. Fig. 11은 식 (6)을 풀어낸 결과이며 각 스프링 자유장 길이를 변화한 경우에 대한 각 스프링의 변위를 나타낸다. Fig. 12는 대응하는 스프링 초기 변위 Δl에 대한 telapsed이다. 스프링 자유장 길이가 길어질수록 telapsed가 줄어든다. 0.1초에서 대응하는 초기 스프링 변위 Δl은 0.04 mm이다. Δl이 증가함에 따라 스프링의 최대 변위 또는 곡선의 피크 값이 감소한다. 따라서, 스프링 길이가 감소함에 따라 Fig. 13에 도시 된 바와 같이 챔버에서 약물로 전달되는 에너지를 증가시키고, 따라서 마이크로 제트의 속도가 증가한다. Fig. 14에 나타낸 실험 결과는 바로 그 사실을 보여준다. telapsed가 Fig. 12와 같이 0.1초 이내에 유지되어야한다는 점에 주목하면, 최적의 초기 스프링 변위는 0.001 mm로 설정할 수 있다.
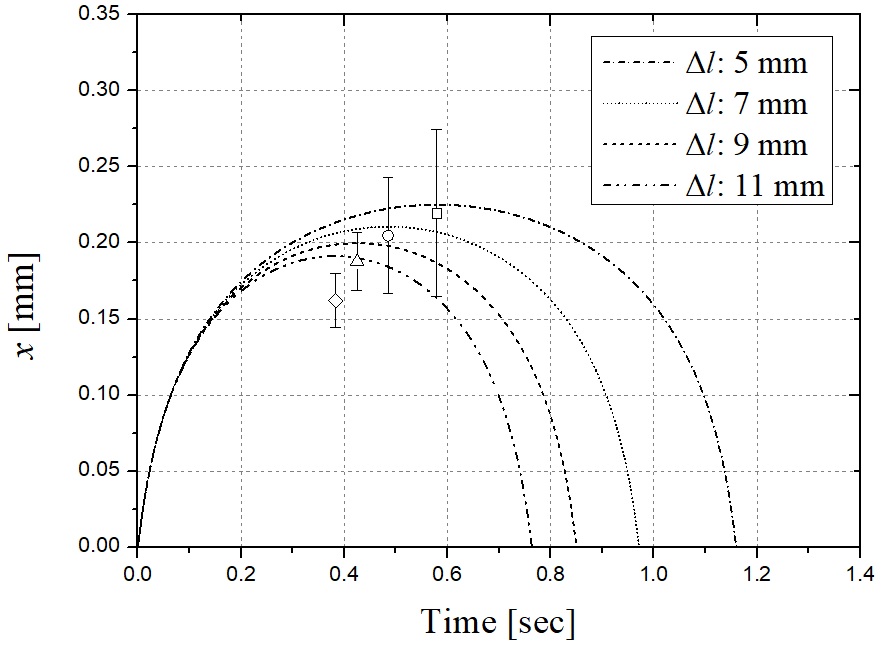
y axis: the spring displacement, x, x axis: time using 4 different Δl. when ks = 12.68 N/m. Each case of experiment was performed 10 times and the range of the experiment value is indicated through the error bars
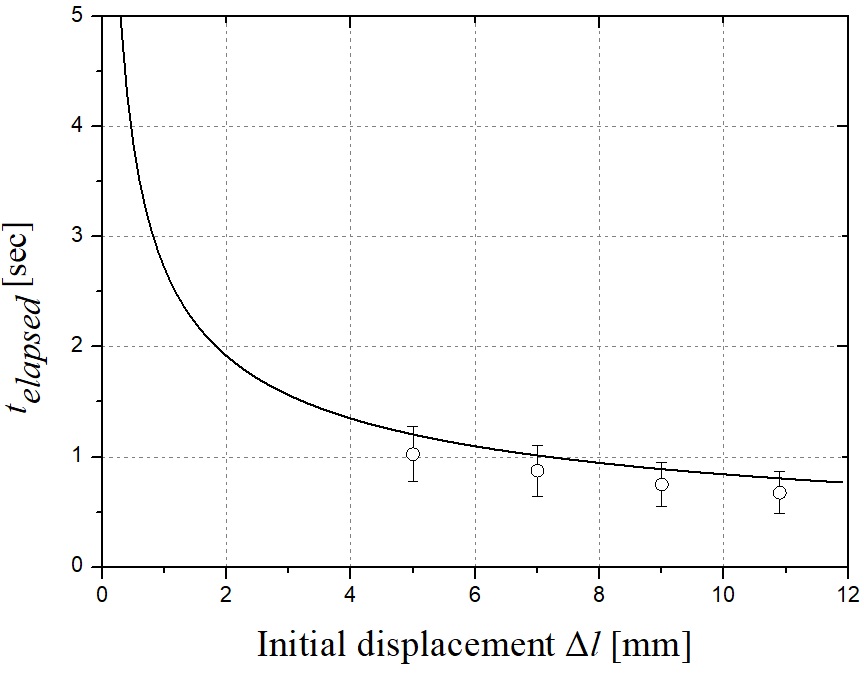
y axis: calculated telapsed, x axis: Δl. when ks = 12.68 N/m. Each case of experiment was performed 10 times and the range of the experiment value is indicated through the error bars
3.3 피부 침투
Table 1은 돼지 피부 각질층을 슬라이싱하여 단면도로 나타낸 약물 침투 결과를 요약한 것이다. 침투 부위를 가시화하기 위해 문신 잉크를 사용 하였다. 약물 주사 횟수 와 침투 성능을 연관시키기 위해 주입 시간 3 내지 20초로 변화시켰다. 밸브가 있는 노즐은 분사 시간을 길게 하여 더 많은 약물을 경피로 투여함에 따라 더 깊은 침투 깊이를 나타냈다.
cross-sectional view of porcin skin when the tatoo ink was injected by valve nozzle and original nozzle.
Fig. 15는 Table 1의 침투 결과를 그래프로 나타낸 것이다. 마이크로 제트 속도는 투여되는 샷의 수에 관계없이 일정하게 유지되고, 밸브 노즐에 의해 침투 깊이도 증가 하였다. Fig. 16에 도시 된 바와 같이, 문신 잉크 주입에 의해 돼지 피부에 나무 이미지를 제작할 수 있었다.
4. 결 론
본 연구에서는 분사 횟수에 관계없이 균일한 마이크로제트 속도를 유지하는 경피 약물 전달 시스템을 개발하였다. 레이저 구동 식 마이크로 제트 인젝터에 도입된 볼 체크 밸브는 주입 성능의 지속성 및 반복성을 크게 향상시켰으며 비침습식 약물 주입 의료 기기에 적합한 것으로 사료된다. 볼 체크 밸브가 있는 인젝터는 각 펄스 약물 분사 이후 후속 내부 압력 강하로 인해 발생하는 외부 공기 유입을 방지할 수 있었다. 이러한 결과로써 샷 수에 관계 없이 140 m/s의 일정한 속도로 마이크로 제트을 반복적으로 분사할 수 있는 성능을 보이는 바이다.
Acknowledgments
이 논문은 2019년도 한화시스템(주)의 재원을 지원 받아 수행된 연구임.
References
-
Claude, A. T., Martin, R. L., Jacques, G. B., Pierre, H. D., 1990, Risk of Cross-Infection Related to the Multiple Use of Disposable Syringes, Can. J. Anaesth, 37:2 156-165.
[https://doi.org/10.1007/BF03005462]
-
Jeanne, C. S., Marcio, G. M., Thomas, H. L., Laleh, J., Sapun, H. P., Daniel, A. F., 2007, Piezoelectric Control of Needle-free Transdermal Drug Delivery, J. Control Release, 124 :1 88-97.
[https://doi.org/10.1016/j.jconrel.2007.08.017]
-
Anubhav, A., Mark, R. P., Samir, M., 2008, Micro-Scale Devices for Transdermal Drug Delivery, Int. J. Pharm. 364:2 227-263.
[https://doi.org/10.1016/j.ijpharm.2008.08.032]
-
Han, T., Yoh, J. J., 2010. A Laser Based Reusable Microjet Injector for Transdermal Drug Delivery, J. Appl. Phys. 107:10 103110.
[https://doi.org/10.1063/1.3430989]
-
Yoh, J. J., Jang, H., Park, M., Han, T., Hah, J., 2016, A Bio-ballistic Micro-jet for Drug Injection into Animal Skin Using a Nd: YAG laser, Shock Waves 26:1 39-43.
[https://doi.org/10.1007/s00193-015-0565-4]
-
Park, M., Jang, H., Sirotkin, F. V., Yoh, J. J., 2012, Er: YAG Laser Pulse for Small-dose Splashback-free Microjet Transdermal Drug Delivery, Opt. Lett. 37:18 3894-3900.
[https://doi.org/10.1364/OL.37.003894]
-
Jang, H., Hur E., Kim, Y., Lee, S., Kang, N., Yoh, J. J., 2014, Laser-induced Microjet Injection into Preablated Skin for More Effective Transdermal Drug Delivery, J. Biomed. Opt. 19:11 118002.
[https://doi.org/10.1117/1.JBO.19.11.118002]
-
Jang, H., Yu, H., Lee, S., Hur, E., Kim, Y., Lee, S., Kang, N., Yoh, J. J., 2014, Towards Clinical Use of a Laser-induced Microjet System Aimed at Reliable and Safe Drug Delivery, J. Biomed. Opt. 19:5 058001.
[https://doi.org/10.1117/1.JBO.19.5.058001]
-
George, M. H., Marvin, R. Q., 1973, Optical Constants of Water in the 200-nm to 200-μm Wavelength Region, Appl. Opt. 12:3 555-63.
[https://doi.org/10.1364/AO.12.000555]
-
Hamed, K., Chang, L., Ravi-Chandar, K., 2014, Dynamic Tensile Characterization of Pig Skin, Acta Mech. Sinica 30:2 125-32.
[https://doi.org/10.1007/s10409-014-0042-9]
- Gallagher, A. J., Annaidh, N. A., Bruyère, K., 2012, Dynamic Tensile Properties of Human Skin, Paper Presented at IRCOBI Conference 2012, 12-14 September 2012, Dublin Ireland.
-
Timmerman, P., Jacobus, P. W., 1999, On the Rise and Fall of a Ball With Linear or Quadratic Drag, Am. J. Phys,67:6 538-546.
[https://doi.org/10.1119/1.19320]